药物临床试验质量管理规范(GCP)的核心内容
稿件来源:深圳市第三人民医院 发布时间:2017-06-22 00:00:00

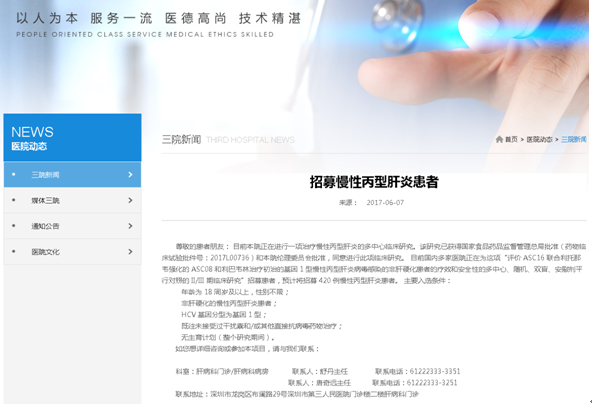
2017年5月19日,深圳市第三人民医院肝病专业组获得了国家食品药品监管总局(CFDA)颁发的药物临床试验机构资格,这标志着我院肝病专业组可以开展新药注册临床试验。6月8日由何清副院长担任主要研究者(Principal Inveistigator, PI)的“慢性丙型肝炎II/III期临床试验”在肝病科已经正式启动。(后附试验的招募信息)

至此,我院拥有药物临床试验资格的专业组有肝病、结核和艾滋。预计未来将会陆续开展更多的新药注册类临床试验,这对于临床研究团队和机构办公室都提出极高的要求,对研究者的药物临床试验质量管理规范(Good Clinical Pratice, GCP)再培训需求迫切。何为GCP?如何在GCP的要求下,科学地进行临床试验研究? 我们在此简单复习一下。
GCP的核心内容是:保护受试者的权益并保障其安全,保证药物临床试验过程规范,结果科学可靠。因为有了GCP的要求,医生升级为研究者,护士升级为研究护士,患者成为了受试者。临床试验不同于临床治疗,其中试验用产品的安全性、疗效、不良事件,都是需要进行全面的试验进行确定。临床试验的过程是摸着石头过河,必须以严谨认真的态度对待。尤其是GCP的核心:保护受试者和结果科学可靠。

具体在保护受试者上,作为研究者,确保试验方案、知情同意书等相关资料已经获得伦理委员会审核批准,充分全面地完成知情同意过程;当受试者出现安全性事件时,应及时处理和报告,保障其安全。
在数据科学可靠上,作为研究者,要认真书写原始病历和记录,及时审阅和评价检查结果,确保数据准确无误地填写在病例报告表(Case Report Form,CRF)中。
深圳市第三人民医院药物基地后续将进行一系列的GCP培训:
《知情同意》
《受试者招募》
《不良事件的管理》
《CRF设计原则与填写》
《原始记录》
《临床试验相关资料的管理》
《试验药物管理》
《核查与稽查》
请广大研究者和对临床试验感兴趣的临床工作人员留意后续通知,也欢迎大家积极参加。
后附慢性丙型肝炎项目的招募信息,详细入选排除标准和试验流程,请咨询:舒丹主任,联系电话:61222333-3351;唐奇远主任,联系电话:61222333-3251。
附件:






 粤公网安备 44030702003859号
粤公网安备 44030702003859号
