深圳三院联合南科大突破CAR-T细胞治疗新技术:脂质纳米颗粒递送实现多重基因编辑,抗癌更精准更安全
稿件来源:深圳市第三人民医院 发布时间:2025-09-01 19:20:532025年8月29日,深圳市第三人民医院(南方科技大学第二附属医院)卢洪洲教授团队与南方科技大学医学院/前沿生物技术学院朱健康院士、曾臣副研究员团队合作,在国际知名期刊《Advanced Healthcare Materials》(JCR分区Q1;5年平均影响因子10.8)上发表题为“Co-Delivery of Multiple RNAs via Lipid Nanoparticles Enables Precise Gene Editing of CAR-T Cells”的研究论文。该研究开发了一种基于脂质纳米颗粒(LNP)的新型递送系统,可同时携带多种RNA分子,实现对CAR-T细胞的高效、精准基因编辑,显著提升其抗肿瘤能力,为肿瘤免疫治疗提供了新策略。

CAR-T疗法:成就与挑战并存
CAR-T细胞疗法是目前肿瘤治疗领域的一项突破性技术,尤其在白血病、淋巴瘤等血液肿瘤治疗中表现出色。然而,传统方法多依赖病毒载体递送CAR基因,存在成本高、制备复杂、潜在致癌风险等问题。此外,肿瘤微环境中的免疫抑制信号(如PD-1/PD-L1通路)也会导致CAR-T细胞功能衰竭,影响疗效。
创新突破:LNP递送系统实现“一石三鸟”
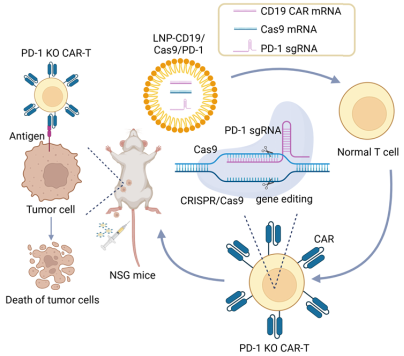
研究团队利用脂质纳米颗粒(LNP)技术设计了一种新型递送平台,可同时封装三种RNA分子:CD19 CAR mRNA,使T细胞能够识别并攻击肿瘤细胞;Cas9 mRNA,编码基因编辑酶;PD-1 sgRNA,引导Cas9精准敲除PD-1基因,解除免疫抑制。通过微流控技术制备的LNP颗粒粒径均匀、包封率高,能高效进入T细胞,实现CAR的快速表达和PD-1的高效敲除,且对细胞活性影响极小。
显著优势:高效、低毒、可多重编辑
与传统电穿孔(EP)或脂质体转染相比,LNP技术显示出了显著优势:(1)转染效率更高,在多种细胞系和原代T细胞中均达到95%以上;(2)细胞活性更好,转染后细胞存活率超过90%;(3)多重编辑能力:还实现了PD-1、TRAC、B2M三基因同时敲除,编辑效率均超75%,为开发“通用型CAR-T细胞”(UCAR-T)奠定基础。
荷瘤动物模型验证:显著抑制肿瘤生长
在荷瘤小鼠模型中,经LNP编辑的PD-1 knockout CAR-T细胞表现出最强的肿瘤抑制效果和最长的小鼠生存期,效果显著优于传统电穿孔组,且未观察到明显毒副作用。
临床意义与未来展望
该研究不仅提供了一种非病毒、高效、安全的CAR-T细胞制备新方案,还展示了LNP平台在多重基因编辑方面的巨大潜力。这项技术未来可用于开发“即用型”CAR-T产品,降低生产成本和治疗门槛,尤其适合资源有限地区推广应用。
下一步,团队将探索LNP的体内靶向递送能力,并拓展至NK细胞等其他免疫细胞类型,进一步推动肿瘤、自身免疫疾病和艾滋病的细胞治疗的临床转化应用。
本文第一作者为南方科技大学博士研究生王梦鸽和深圳三院助理研究员廖启彬博士,通讯作者为卢洪洲教授、朱健康院士和曾臣副研究员,南方科技大学医学院/前沿生物技术学院为论文的第一单位。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/adhm.202501475
附件:






 粤公网安备 44030702003859号
粤公网安备 44030702003859号
