2024年器官移植领域十大重要研究成果
稿件来源:深圳市第三人民医院肾移植一科 发布时间:2024-12-20 08:20:34一、世界第一例成功的转基因猪肾异种移植
2024年,全球首例异种肾移植术的受者是一位名叫里克(Rick Slayman)的62岁男性。里克长期患有2型糖尿病和高血压,七年前开始接受透析,2018年12月在麻省总医院接受了已故捐赠者的肾脏移植手术。然而,移植的肾脏在一年后开始出现衰竭迹象,里克不得不在2023年5月恢复透析。
由于反复出现严重的血管通路并发症,里克需要每两周就到医院进行治疗。继续等待移植肾源将花费5~6年的时间,期间他有可能因为严重并发症而去世。因此,治疗团队申请了FDA的“同情使用”程序,即对于患有严重、危及生命的疾病或状况的患者,在没有可比治疗的情况下,可以获得实验性治疗或试验的机会。在与FDA长达十二个月的交流与器官移植候选名单的多轮筛查中,麻省总医院移植中心选中了里克。
2024年3月16日,里克在麻省总医院接受了世界上首例猪肾移植手术。供体来自于一只基因编辑猪,经过69项基因修饰培育,去除了有害猪基因、灭活猪内源性逆转录病毒,以消除人类感染的风险。手术团队成功将基因编辑猪肾移植到里克体内,这也是世界上首次将猪肾移植到活体受体中。
术后,里克的身体状况良好,他甚至曾两次前往购物中心。然而,不幸的是,他在手术两个月后因意外的心脏事件去世。尸检显示,患者没有肾脏排斥反应或其他异常现象,表明移植的猪肾并未导致他的死亡。从接受移植到死亡,里克共生存了51天时间。
里克的案例是异种器官移植领域的一个重要里程碑,尽管他的去世令人遗憾,但他的移植经历为未来的异种器官移植研究提供了宝贵的数据和经验。这一进展不仅为解决全球性的器官短缺问题提供了新的可能性,也为无数等待器官移植的患者带来了新的希望。
二、世界首例部分心脏移植手术在1年后状态良好
2024年1月2日,杜克大学医学中心的研究人员在《美国医学会杂志》(JAMA)上发表了题为:Partial Heart Transplant in a Neonate With Irreparable Truncal Valve Dysfunction 的论文。2022年4月22日,杜克大学医学中心的研究人员给一名新生儿进行了世界首例部分心脏移植手术,这名新生儿在出生时患有永存动脉干先天畸形,即左、右主冠状动脉融合在一起,同时存在一个瓣膜的心房反流。这种情况使得患者在接受完整的心脏移植前不太可能存活下来。因此,研究团队采用了来自另一个婴儿的心脏组织,虽然不适合完整心脏移植,但其具有良好的瓣膜,可用于移植手术。Joseph Turek 博士表示,部分心脏移植是一种新的方法,给生长中的新生儿提供心脏瓣膜植入物,仅涉及移植包含流出道瓣膜的心脏部分,而保留自体心室。部分心脏移植不同于尸体同种移植,因为它们像心脏移植一样被处理以保持瓣膜的活力。这使得部分心脏移植物能够像心脏移植物中的瓣膜一样生长。表1展示了部分心脏移植、同种移植和心脏移植之间的差异。
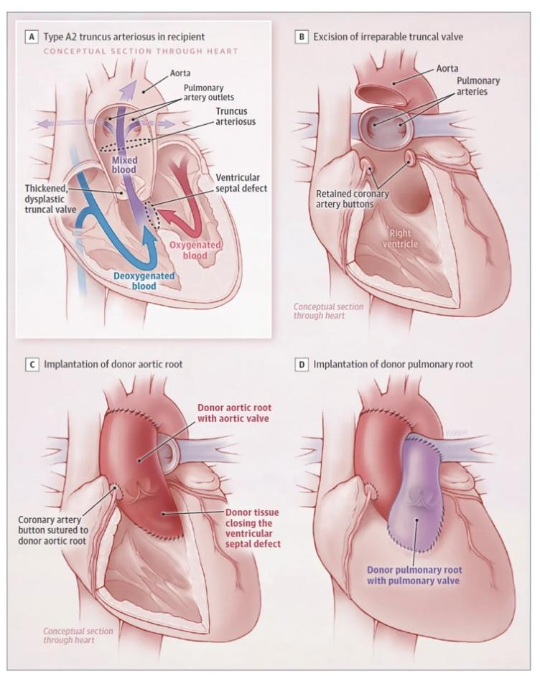
这项创新为多米诺心脏移植铺平了道路,让一个心脏供体可以挽救两个生命。在多米诺心脏移植中,一个拥有健康瓣膜但需要心肌的患者接受完整心脏移植,然后,把他的健康瓣膜捐赠给另一个有需要的患者,从而创造多米诺效应。在所有捐赠的心脏中,大约一半符合用于完整心脏移植的标准,但还有大约同样数量的心脏可以用于瓣膜移植,这样就可以将用于心脏病儿童的心脏数量翻倍。将这一创新应用于临床试验将是实现心脏手术量、大幅改变心脏供体可用性的一大进步。
三、多能干细胞制备的胰岛细胞治疗糖尿病
2024年9月25日,天津市第一中心医院沈中阳、王树森研究组,北京大学、昌平实验室邓宏魁研究组,和杭州瑞普晨创科技有限公司合作在Cell发表题为Transplantation of Chemically Induced Pluripotent Stem-Cell-Derived Islet Under Abdominal Anterior Rectus Sheath in a Type 1 Diabetes Patient的研究论文,在国际上首次报道了利用化学重编程诱导多能干细胞制备的胰岛细胞移植,治疗1型糖尿病的临床研究。首位患者在移植后恢复了内源自主性、生理性的血糖调控,移植75天后完全稳定地脱离胰岛素注射治疗,目前疗效已稳定持续1年以上(图1)。该研究初步证明化学重编程多能干细胞制备的胰岛细胞疗法安全有效,实现了1型糖尿病的临床功能性治愈。
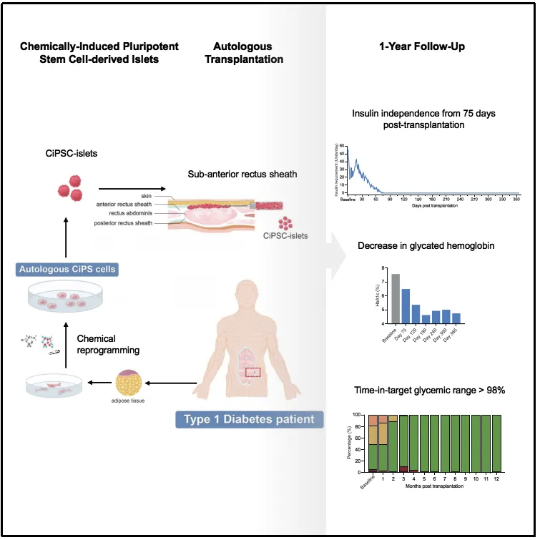
本研究对于糖尿病治疗具有重要意义。糖尿病是全球范围内威胁人类健康的重大疾病之一,并且我国已成为全球糖尿病患病人数最多的国家。当前常用的治疗方法,如胰岛素注射、降糖药物,难以实现血糖的精准调控,导致多种并发症发生,严重影响患者的生活质量,甚至会危及生命。经过四十多年的临床积累,胰岛移植治疗糖尿病已取得较好的临床疗效,但人胰腺供体短缺的问题,严重限制了其广泛应用。
人多能干细胞制备的胰岛细胞为糖尿病移植治疗提供了新的来源。多能干细胞具有无限增殖的特性和分化成生物体所有功能细胞类型的能力,在细胞治疗、药物筛选和疾病模型等方向具有广泛的重要应用价值,是再生医学领域最具潜力的“种子细胞”。
本研究利用人CiPS细胞制备的胰岛,建立了糖尿病的细胞治疗新途径,实现了临床功能性治愈糖尿病。更为重要的是,化学重编程技术制备的功能细胞在临床治疗疾病的成功,表明了化学重编程有望成为高效制备各种功能细胞类型的通用底层技术,为细胞治疗在重大疾病治疗上的广泛应用开辟了一条新的途径。
四、Cell:突破类器官研究限制!利用胰腺细胞创造了一个新的类器官
来自Hubrecht研究所的类器官小组的研究人员已经开发出一种模仿人类胎儿胰腺的新类器官,为其早期发育提供了更清晰的视角。研究人员能够重建一个完整的结构,包括胰腺中的三种关键细胞类型,这是以前的类器官无法完全模仿的。值得注意的是,研究小组发现了一种新的干细胞,可以发育成这三种细胞类型。这些发现发表在12月2日的《细胞》杂志上,可以帮助研究人员更好地了解胰腺,并在未来开发出治疗胰腺疾病的新方法。
胰腺有两个主要功能:帮助消化食物和控制血糖水平。对于这些任务,器官使用不同类型的细胞。科学家们可以通过观察类器官来研究胰腺是如何工作的。类器官是一种在实验室中生长的大约1毫米大小的微小器官。然而,到目前为止,大多数类器官一次只能存在一种类型的细胞。这使得科学家很难从整体上理解胰腺。Andersson Rolf和她的同事们利用胰腺组织创造了一个新的三维类器官,模仿胎儿时期的人类胰腺。这种类器官包含三种主要类型的胰腺细胞:腺泡细胞、导管细胞和内分泌细胞。每一个细胞都起着至关重要的作用。腺泡细胞释放帮助分解食物的酶,而导管细胞形成通道将酶运送到肠道。最后,内分泌细胞产生胰岛素等激素来控制血液中的血糖水平。这种模仿胎儿胰腺的新类器官可以为科学家研究基因和环境如何影响胰腺的发育和健康提供新的途径。最终,研究这些类器官可以帮助开发再生疗法和治疗胰腺疾病的新药。
五、我国学者在异种移植领域取得重大进展——为猪肾人体移植后的长期存活奠定基础
近年来,以CRISPR基因编辑为代表的生物技术领域突破为基因工程猪肾脏异种移植铺平了道路,其标志是8例移植手术成功地将猪器官移植到脑死亡遗体内(其中6例肾脏异种移植,2例心脏异种移植)。这些研究表明,靶向基因修饰可以有效克服猪-人异种移植中遇到的天然超急性排斥反应。
然而,脑死亡遗体模型虽然在临床相关性方面超越了非人灵长类动物(NHP)模型,但其在观察持续时间短,已报道的研究持续时间从54-74小时不等,最长也仅为7天,这可能导致无法充分研究急性异种移植排斥反应的病理生理变化。
2024年9月23日,海南医科大学第二附属医院王毅教授团队联合华中科技大学同济医学院附属同济医院陈忠华教授、陈刚教授、成都中科奥格生物科技有限公司潘登科博士及澳门科技大学张康教授,在 Cell 子刊 Cell Reports Medicine 上发表了题为:Pig-to-human kidney xenotransplants using genetically modified minipigs的研究论文。
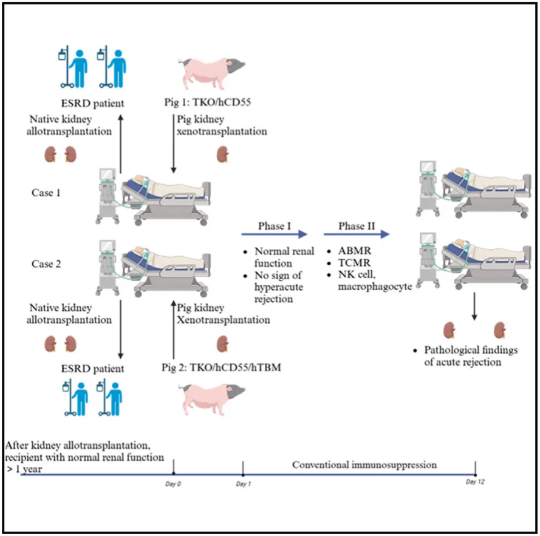
该研究在脑死亡遗体中使用来自基因编辑的小型猪的肾脏,进行了两例成功的猪肾脏异种移植,遗体的肾功能得到了完全恢复,在长达12天的观察中,研究团队描述了异种移植后的免疫学和病理生理学变化,以及猪巨细胞病毒(PCMV)再激活对移植器官存活的影响,突显了该模型将异种移植推向临床应用的潜力。
在这项最新研究中,研究团队在获得脑死亡捐献者的家属完全知情同意及书面授权后,通过维持血流动力学稳定,尽可能延长猪肾脏异种移植后的观察期,直至异种移植肾脏功能障碍或出现特定情况时终止。
这种更长的时间跨度研究,使团队能够全面地分析异体移植器官排斥和功能障碍的过程,尤其是超急性排斥阶段,为这一开创性手术的关键方面提供了新见解,尤其是移植免疫学,最终目标是实现移植猪肾长期的肾脏功能恢复。
具体来说,该研究开发了一种观察模型,用于评估肾脏异种移植后的肾脏功能恢复和异种免疫反应,重点关注基因编辑和免疫抑制效果。该研究强调了延长观察期以及对亚临床脑死亡模型进行全面评估的重要性,以推进我们异种移植研究的深入,从而成功实现异种移植物长期带功能存活。
六、工程化合成抑制性T细胞实现局部靶向免疫保护程序
在最新一期《Science》发表题为“Engineering synthetic suppressor T cells that execute locally targeted immunoprotective programs”的文章中,Nishith R. Reddy等研究者探讨了一种新型合成抑制性T细胞的工程化方法,这些细胞能够在局部执行免疫保护程序。现有的许多炎症或自身免疫性疾病的治疗方法会导致全身性免疫抑制,从而引发严重和长期的毒性反应。如果能够仅在特定组织或移植部位进行局部免疫抑制,就可以克服这些全身性毒性以治疗多种炎症性疾病。免疫系统的稳态需要炎症和抑制活动的平衡。通过工程化常规CD4+ T细胞,使其具备合成Notch(synNotch)受体,这些受体在识别特定抗原时会启动抗炎因子的生产。研究人员构建了一系列抑制程序,发现最有效的合成抑制性T细胞能够同时产生抗炎因子(如IL-10、TGFb1、PD-L1)和炎症因子的“汇集”(如IL-2受体CD25)。这种设计模仿了天然调节性T细胞的进化特征,能够有效地抑制细胞毒性T细胞的活性,并在体内实验中成功保护了移植的胰岛样器官免受免疫攻击。通过这种方式,合成抑制性T细胞有望在不影响全身免疫功能的情况下,提供针对性免疫抑制,应用于癌症、移植排斥和自身免疫疾病的治疗。
通过工程化合成抑制性T细胞来实现局部免疫抑制,以解决现有针对炎症或自身免疫性疾病治疗中全身免疫抑制带来的毒性问题。研究人员通过设计合成Notch(synNotch)受体回路,在常规CD4+ T细胞中引发抗炎因子的产生,从而实现了局部免疫抑制。这种合成抑制性T细胞能够有效地阻止细胞毒性T细胞的攻击,如CAR T细胞,同时不影响其针对肿瘤的特异性杀伤功能。此外,这些细胞在胰岛移植模型中也显示出了保护功能,避免了全身性免疫抑制。
通过工程化合成抑制性T细胞,可以实现针对多种疾病背景下的局部免疫抑制。这些细胞通过同时作为抗炎因子的来源和促炎细胞因子(如IL-2)的“消耗池”来模仿自然调节性T细胞的功能设计。这种设计不仅可以在体外有效抑制CAR T细胞的细胞毒性,还能够在体内保护特定组织不受CAR T细胞的交叉反应影响,而不影响其对肿瘤的特异性杀伤能力。此外,这些合成抑制性T细胞还可以在小鼠胰岛移植模型中保护移植物免受细胞毒性T细胞的排斥。研究结果展示了合成抑制性T细胞作为治疗平台的潜力,可用于治疗自身免疫疾病、预防移植排斥以及减少CAR T细胞治疗的毒性反应。
七、世界首例自体再生胰岛移植成功
中国科学家在2型糖尿病(T2D)治疗领域取得突破性进展,成功实施世界首例自体再生胰岛移植。该研究由海军军医大学第二附属医院与中国科学院团队联合完成,成果发表在《Cell Discovery》杂志。研究中,通过将患者血液重编程为自体诱导多能干细胞(iPSCs),体外再造胰岛组织,显著改善了患者的血糖控制,减少了胰岛素需求,并提升了HbA1c和空腹C-肽水平。此项技术有望为糖尿病治疗提供新方向。
2型糖尿病(T2D)常伴随着胰岛素抵抗和胰岛β细胞功能逐渐衰退,导致了胰岛素的生产和分泌不足,这使得治疗的复杂性大幅提升。传统的治疗方法难以根治疾病,胰岛移植的巨大潜力为临床带来了希望。然而,供体器官的严重短缺以及移植后的免疫排斥反应,限制了其在大规模临床应用的可能。
近年来,干细胞技术的发展有望弥补这个局限,其利用人多能干细胞(hPSCs)通过诱导分化,可产生胰岛组织。但是,hPSCs衍生细胞的临床应用因复杂的分化过程和残留未分化细胞形成畸胎瘤的风险而受限,亟需寻找一种既能避免免疫排斥又能高效产生胰岛细胞的干细胞类型。
究团队经过十余年的探索,实现了世界首例自体再生胰岛移植治愈糖尿病并获得成功,突破了全球糖尿病治疗领域数十年来悬而未解的瓶颈,是中国医学界的骄傲。值得注意的是,研究团队选用非肿瘤源性的EnSCs作为胰岛细胞前体,这种材料在体内不会引发肿瘤,且适合大规模培养胰岛细胞。而其选择T2D患者作为研究对象,而非T1D患者,是为了避免自身免疫状态对E-islets植入和功能评估的影响,同时也扩展了胰岛移植的适应症范围。
不过,本研究仍有局限性,其无法完全排除手术可能改善残留内源性胰岛细胞功能的可能性。因此,研究团对还在进行样本量的扩大,并对完全失去胰岛β细胞的T1D患者进行额外研究。截至目前,研究团队已成功开展并治愈了多例脆性1型糖尿病患者,这将有助于明确E-islets在达成血糖控制目标中的确切作用。
八、全球首例全眼移植手术
2024 年 9 月 9 日,纽约大学朗格尼医学中心(NYU Langone Health)的手术团队在《美国医学会杂志》(JAMA)发表了题为「Combined Whole Eye and Face Transplant:Microsurgical Strategy and 1-Year Clinical Course」的报道,跟踪了全球首例接受全眼移植手术(含部分面部组织移植)的患者术后一年多的移植眼睛健康状态。
2021 年 6 月,一名健康状况良好的 46 岁男子亚伦 · 詹姆斯遭受高压电击事故,导致左眼、左眼睑、鼻子、嘴唇以及包括皮肤和模拟肌肉组织在内的大量面部组织丧失。
2023 年 5 月 27 日,亚伦在纽约大学朗格尼健康中心移植了来自捐赠者的整个左眼和部分面部组织。长期以来,全眼移植被认为是不可能完成的任务,因为眼部结构极为复杂,手术还面临免疫排异、神经血管吻合等难点,包括我国在内,角膜移植已常态化,但此前这么多年,全球都在研究全眼移植,却从来没有人成功过。即便是在动物实验中,「移植眼」的最高存活纪录也只有 30 天。亚伦的诊疗团队使用创新的手术方案:首先,他们摘取了供体包括周围眼组织在内的整个左眼用于移植,含眼球、眼窝、眼睑、眼眶骨骼,以及与之相连的血管、神经网络等,这被称为「带血供的复合组织同种异体移植(VCA)(详见图 2),常多用于手部、面部移植,它能有效重建、恢复形态和功能,风险是更易出现免疫排斥;其次,手术团队没有采取常规切除部分颅骨后连接血管和供体眼球的方式,而是通过术前血管造影,利用亚伦靠近眼眶外壁的颞浅动脉分支,与供体眼球的动脉血管相连,仅耗时 25 分钟就完成血管吻合。术后半年,亚伦的视网膜和脉络膜实现灌注,且有移植眼足够血供和内部流体压力,可以分泌眼泪。术后一年,亚伦的眼周神经进一步恢复,他左眼眶深处开始有瘙痒感,眼轮匝肌和左侧面部肌肉功能不断改善。移植眼的眼压稳定在 8-11 mmHg,没有出现动物实验中逐渐干瘪、萎缩等不良情况。迄今,亚伦没有出现急性排异。
九、人iPSC-肝脏类器官移植,治疗肝纤维化
2024年7月24日,横滨市立大学、东京大学的研究人员在 Science 子刊 Science Translational Medicine 上发表了题为:Human iPSC–liver organoid transplantation reduces fibrosis through immunomodulation 的研究论文。研究团队通过将数百个人诱导多能干细胞-肝芽(hiPSC-LB)融合,构建出人诱导多能干细胞来源的肝脏类器官(hiPSC-LO),以诱导静态细胞-细胞相互作用,并发现这些在移植后包含复杂的结构,例如肝细胞、血管和胆管。这种融合使得能够生成适合移植到免疫缺陷的肝纤维化动物模型中的大的人体组织。hiPSC-LO与hiPSC-LB相比显示出更优越的肝功能,并且在移植后提高了存活率和肝功能。
此前,研究团队通过模拟早期肝脏发育过程生成了人诱导多能干细胞-肝芽(hiPSC-LB),将其植到患有亚急性肝衰竭的小鼠体内,提高了它们的存活率,这表明了类胚胎组织移植的治疗效果。若要将胚胎阶段器官发生的机制应用于成年人疾病的再生治疗,重点应放在胚胎器官中的细胞-细胞相互作用上,这会激活与细胞分化和血管生成相关的各种信号通路。研究团队旨在探究胚胎肝脏移植作为肝纤维化治疗方法的有效性,并确定类胚胎肝脏的人诱导多能干细胞来源的肝脏类器官(hiPSC-LO)是否能成功模拟这一活性。具体而言,该研究旨在确定是否可以通过体内hiPSC-LO诱导的M2型巨噬细胞极化改变肝脏微环境来改善肝纤维化。hiPSC-LO移植通过免疫调节作用,特别是对CD163+ M2型巨噬细胞极化的作用,改善了化学诱导的肝纤维化,这是导致器官功能障碍的肝硬化症状。
这项研究表明,人诱导多能干细胞来源的肝脏类器官(hiPSC-LO)移植是治疗肝纤维化的一种有前途的新的治疗选择。
十、基因编辑猪肾移植存活184天
为解决移植器官来源不足问题,医学界一直在探索将动物器官用作移植来源,但异种器官移植常出现难以完全避免免疫排斥反应及微血栓形成问题。基因编辑猪提供器官给人实施异种移植,是前沿生物技术的重点研究方向。
我国同种器官移植临床应用技术已达国际先进水平,基因编辑猪的研发能力也接近国际先进水平,但在基因编辑猪到非人灵长类动物实验中,猪肾移植给猴子迟迟未能实现长期存活。这成为制约我国异种肾移植进入临床研究的一大瓶颈。
华中科技大学同济医学院附属同济医院器官移植研究所教授陈刚团队在异种移植研究方面取得突破——基因编辑猪肾移植在猕猴体内存活超过半年。这在国内尚属首次。
陈刚团队于今年5月10日,在经过动物实验伦理批准后,采用pCMV阴性的4基因编辑猪作为供体, 将单个猪肾移植给猕猴,同时切除猕猴的自体双肾,通过改进免疫抑制方案,最终移植肾存活184天。在移植后5个月内,猕猴的移植猪肾功能完全正常,各项生理指标也基本正常,之后出现逐渐加重的蛋白尿,病理证实发生了新生异种抗体介导的慢性排斥反应。
陈刚介绍,对于异种移植动物实验而言,存活180天即代表着实现长期存活。在国际报道中,猴子移植基因编辑猪肾后长期存活的已接近20例。美国已率先开展将猪肾移植给尿毒症病人的临床尝试,而我国若要开展类似临床病例研究,仍需先在动物实验中解决长期存活的问题。此次基因编辑移植肾存活184天,标志着国内异种移植成功的第一步,为后续向临床研究推进奠定了实验基础。
附件:






 粤公网安备 44030702003859号
粤公网安备 44030702003859号
