深圳国家感染性疾病临床医学研究中心/德国埃森大学医院病毒研究所团队解析慢乙肝患者肝内炎症相关基因细胞特异性差异表达探索肝内炎症发生机制
稿件来源:深圳市第三人民医院 发布时间:2024-07-05 08:49:41近日,深圳三院—深圳国家感染性疾病临床医学研究中心卢洪洲/陆蒙吉/王俊/李倩团队在iMeta(IF=23.7,位列微生物学期刊全球TOP 2/161)发表了题为 Cell-type specific expression analysis of liver transcriptomics with clinical parameters to decipher the cause of intrahepatic inflammation in chronic hepatitis B 的研究论文,如下:
DOI:http://doi.org/10.1002/imt2.221
全球约有2.6亿人感染乙型肝炎病毒(HBV),每年因肝硬化和肝细胞癌导致超过100万相关死亡人数。在HBV的持续感染中,宿主免疫反应无法控制病毒,可能导致进行性肝损伤、肝硬化和癌症。然而,慢性乙型肝炎(CHB)中肝脏炎症形成的机制尚未完全了解。虽然核苷(酸)类似物联合干扰素等抗病毒疗法被广泛使用,但这些治疗方法无法根除病毒,由于缺乏直接针对肝脏炎症的干预方法,实现CHB的功能性治愈仍是一大挑战。
多组学研究是目前揭示肝脏炎症形成机制的最有前途的方法之一。Vanwolleghem等人最早在CHB患者的外周血转录组数据中发现,免疫活动期患者B淋巴细胞和天然免疫反应被激活,而T淋巴细胞在CHB的所有阶段都被激活。Lebosse等人进一步在CHB患者的肝组织中进行了转录组研究,报道了在HBeAg阳性患者中,天然免疫相关干扰素刺激基因(ISGs),如CXCL10、GBP1、IFITM1、IFNB1、IL10、IL6、ISG15、TLR3、SOCS1和SOCS3,受到了抑制。2021年,van Buuren等人报道,在免疫活动期的CHB患者中,干扰素信号通路上调,肝内免疫细胞数量增加,强调了免疫调节在实现HBV功能性治愈中的重要性。2022年,Montanari等人也报道,在CHB的免疫活动期,干扰素刺激基因、免疫检查点基因(CTLA4、PDCD1、ICOS)和趋化因子基因(CXCL9、CXCL10)上调。由于基因的上调可能是由于肝组织中免疫细胞数量增加,导致与免疫细胞相关的基因平均表达水平增加,因而使用平均表达量的分析方法则无法在细胞水平上完全阐明参与炎症的免疫通路以及ISGs在不同细胞类型中的特定表达差异。单细胞测序技术则提供了一种可能有效方法来解决上述问题。然而,现有针对免疫活动期的患者肝内单细胞测序的样本量较少,这使得构建活动期两种细胞亚型与临床数据相关性的统计模型时存在挑战。
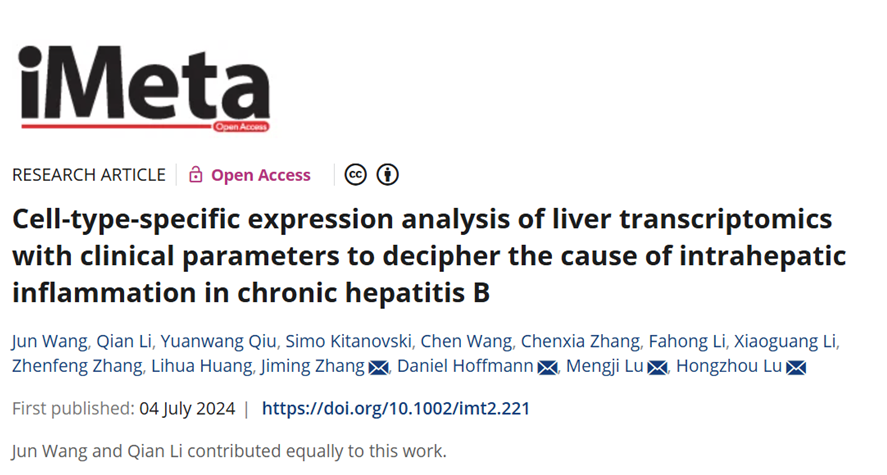
基于上述背景与领域研究局限,研究团队采取将肝脏组织转录组数据与单细胞测序数据和临床数据相结合,从多组学角度分析CHB中肝脏炎症的形成因素。研究团队开发了一种贝叶斯线性模型,用于研究基因表达和临床参数之间相关性。此外,通过从CHB患者和健康肝组织获得的单细胞测序数据筛选出细胞类型标志基因,研究团队进一步更新了细胞特异性表达分析方法(PSEA),在不同临床阶段将整体基因表达拆分为特定细胞类型的表达。研究团队将这两个模型整合到一起分析之前报道的与肝脏炎症相关的免疫过程,如炎症细胞浸润、免疫细胞活化、T细胞耗竭、趋化因子及其受体表达、先天免疫活化和干扰素刺激基因(ISGs)表达,绘制了一张更全面的CHB肝脏炎症发生图谱。此外,通过对CHB患者肝组织样本进行多重免疫染色加以验证。
文章主要内容总结如图1。
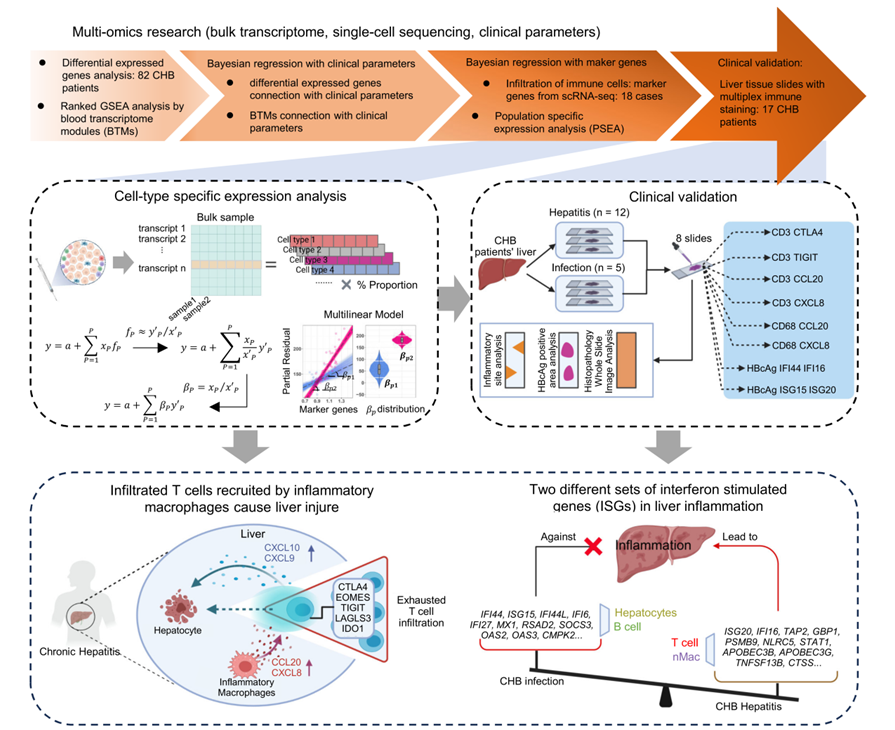
图1:图例摘要
研究团队首先对82例 CHB患者根据临床数据进行了无监督聚类(图2A)。主成分分析(PCA)结果显示,根据各组间差异表达基因(DEGs),可以将慢乙肝炎症患者与慢性感染患者区分开来(图2B)。然而,患者的HBeAg阳性或阴性状态在PCA图中并未明显区分。我们将排名前35的差异表达基因进行GO分析。结果显示与免疫过程相关的通路被显著富集(图2D)。进一步的基因富集分析显示(图2E),在多种已知的肝损伤途径中(包括焦亡、程序性坏死、凋亡和自噬性细胞死亡),凋亡相关的通路具有最高的富集分数。这些发现进一步指出了宿主免疫反应与肝损伤之间的关联。
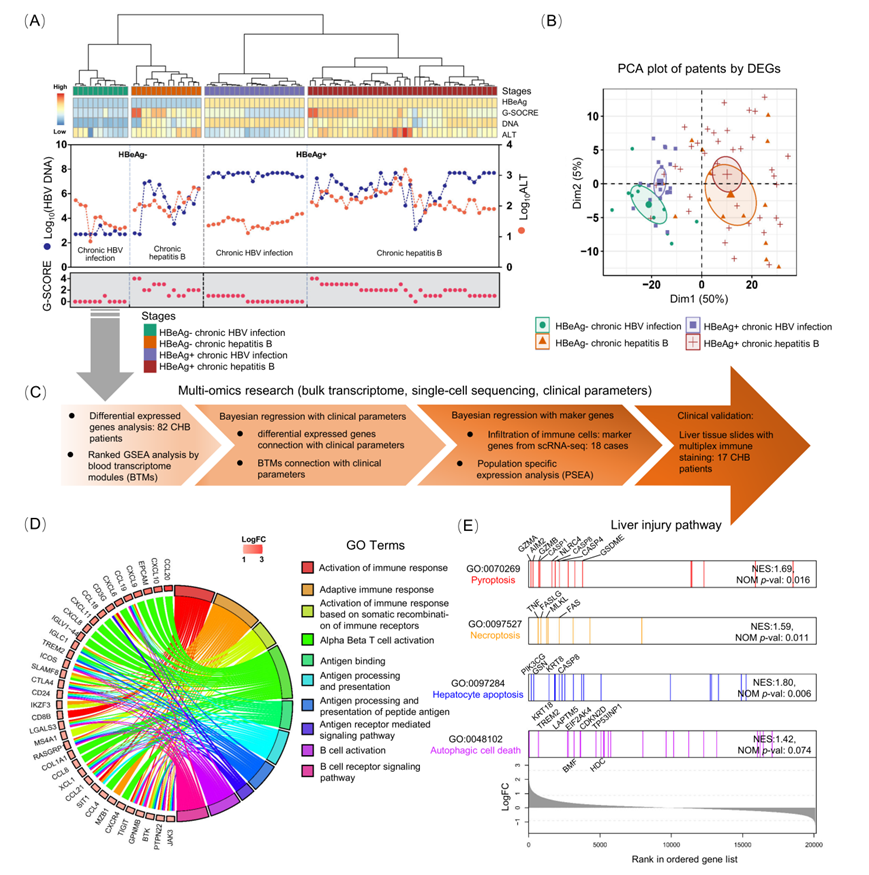
图2. 慢性乙型肝炎(CHB)患者在四个自然史时期的聚类
此外,研究团队通过从CHB患者和健康肝组织获得的单细胞测序数据筛选出细胞类型标志基因。从人类肝脏获取的三个10×基因组单细胞RNA测序(scRNA-seq)数据集(图3A,3B)。使用UMAP数据降维的方法映射和可视化了并分别被标记了肝脏中的主要细胞亚群。T细胞在CHB患者肝脏中的比例较高(图3C)。αβ T细胞在肝脏T细胞中占据最大的一部分,并且它们在CHB肝脏中的数量比正常供体肝脏中更多。已知的标志基因(CD8A、CD3D、NKG7、GZMB、CD68、CD163、S100A8、CD79B、IGKC、ALB、PCK1和CYP2E1)被投影到UMAP图上进一步认证(图3D)。使用层次聚类法识别肝内主要细胞类型标志基因,共发现92个标志基因(图3E)。
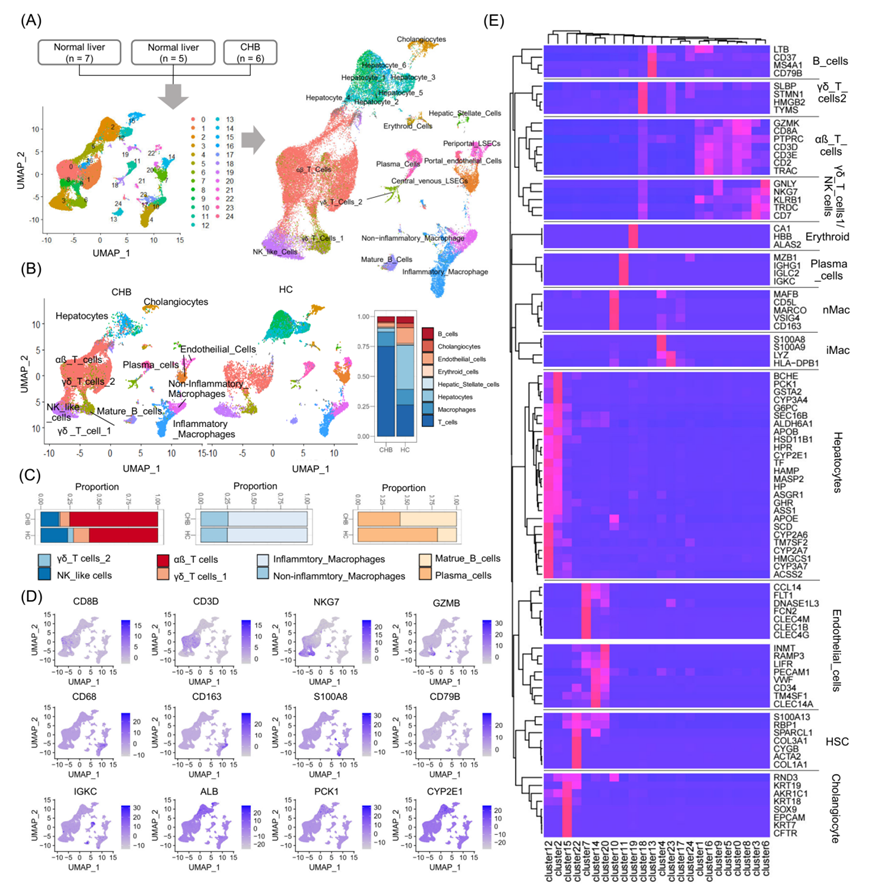
图3. 基于单细胞RNA测序数据的肝脏细胞类型特异性标志基因
在肝炎阶段的肝组织样本中,T细胞(αβ T细胞、γδ T1、γδ T2)、NK样细胞、成熟B细胞、浆细胞B细胞以及炎症性和非炎症性巨噬细胞(iMac和nMac,分别)的标志基因均表达上调(图4A,左侧)。细胞标志基因表达与血清ALT水平和HBV DNA载量的相关性图显示,ALT与大多数T细胞、iMac和nMac细胞标志基因表达呈正相关,而与肝细胞标志基因表达呈负相关(图3A,右侧)。对四例慢性肝炎患者的肝组织切片进行多重免疫组化染色,结果显示淋巴细胞在胆管浸润部位的比例最高,且该部位的T细胞和B细胞比例大于整张切片(图4B)。CHB肝炎患者肝内特征在于肝内各种免疫细胞的浸润(图4C)。
在肝炎阶段肝脏中免疫相关基因的表达增加可能是由于免疫细胞浸润增多或免疫细胞激活导致胞内基因表达上调。之前的研究表明,线性模型可以用于大多数基因的差异表达分析。特定细胞类型的基因表达可以描述为与该群体大小呈线性关系。在临床样本中准确测量不同细胞类型的群体大小通常是不可能的。然而,Kuhn等人开发了一种多重线性回归方程,根据标志基因的表达水平描述特定细胞类型的相对细胞群体大小。作者研究团队进一步发展为贝叶斯多重线性回归模型,设定一个相对于特定标志基因的 β 值代表某一细胞类型中标准化的基因表达。图4D显示了HBeAg阳性感染阶段和相应的肝炎阶段的最小二乘拟合,其中直线的斜率是从 PSEA 方程中得出的 β 值。小提琴图显示了不同临床阶段每个基因的斜率分布及其75%置信区间(图4E)。
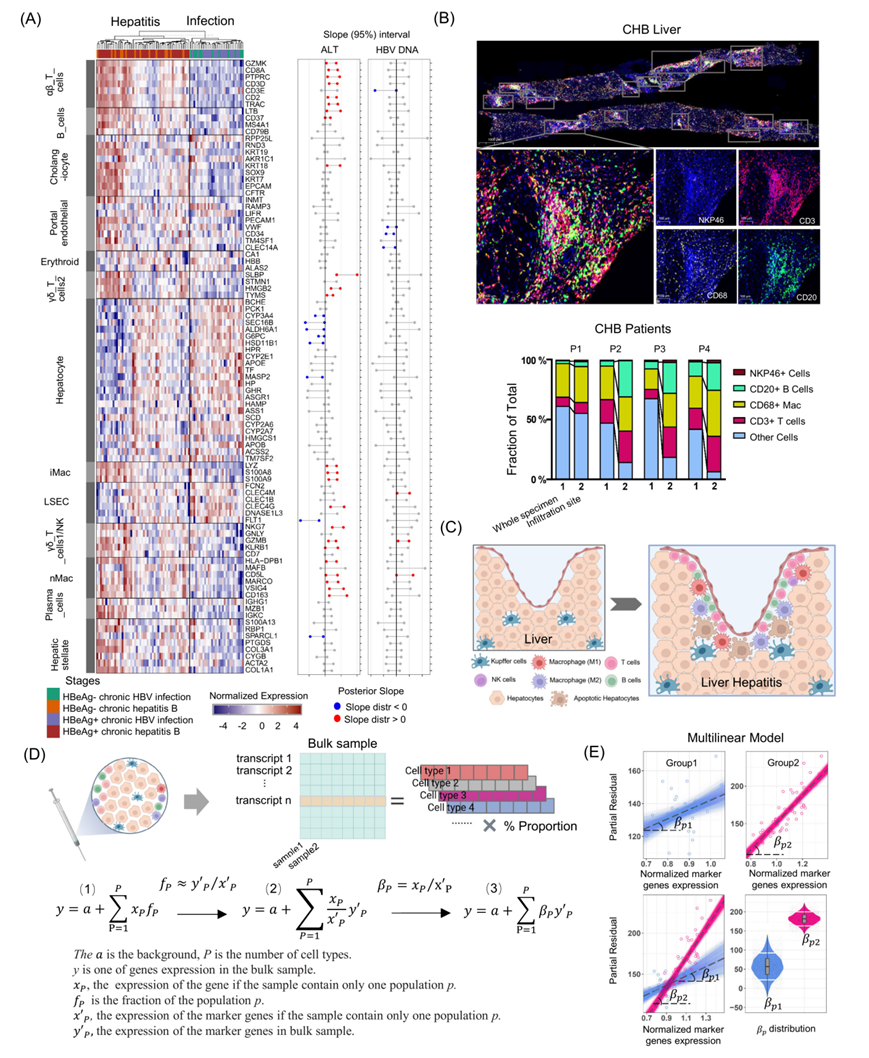
图4. 将整体基因表达解析为特定细胞类型在不同CHB阶段的人群特异性表达分析
研究团队进一步将以上贝叶斯模型整合到一起分析之前报道的与肝脏炎症相关的免疫过程,如炎症细胞浸润、免疫细胞活化、T细胞耗竭、趋化因子及其受体表达、先天免疫活化和干扰素刺激基因(ISGs)表达,绘制了一张更全面的CHB肝脏炎症发生图谱,据此揭示趋化因子和免疫耗竭标志物与肝损伤密切相关。结果表明趋化因子,包括CXCL8和CCL20,在iMac中显著表达,促进了肝脏对T细胞的招募,这些T细胞表现出较高的CTLA4、EOMES、TIGIT、LAG3和IDO1的基因表达。招募的T细胞进一步释放趋化因子CXCL9和CXCL10,可进一步促进T细胞的浸润(图5)。
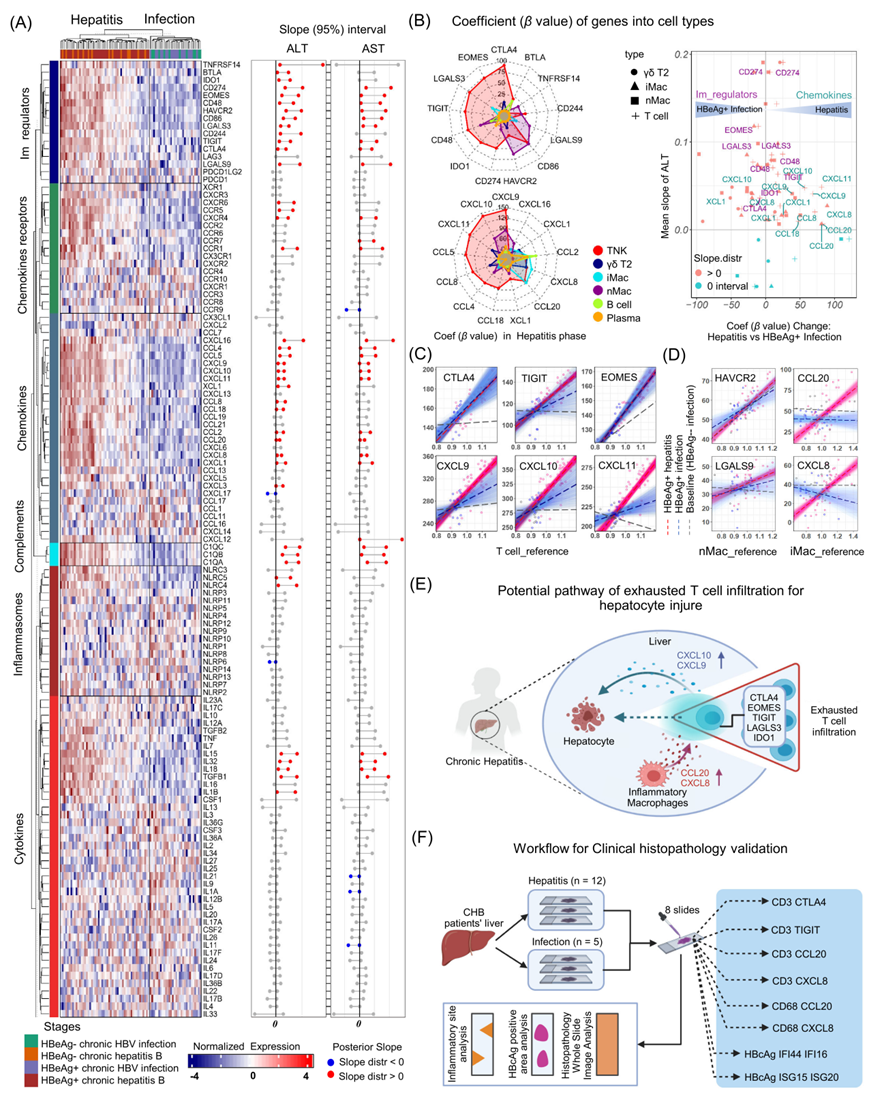
图5. T细胞和巨噬细胞中与肝损伤相关的趋化因子和免疫负调节分子
为了验证多组学分析得到的结果,研究团队将来自17名CHB患者的肝组织切片分为两个不同的临床组:12名HBeAg阳性肝炎患者和5名HBeAg阳性但无肝脏炎症的感染患者。通过对CHB患者肝组织样本进行多重免疫染色加以验证, 得到T细胞耗竭标志物及巨噬细胞活化相关趋化因子的病理验证(图6)。
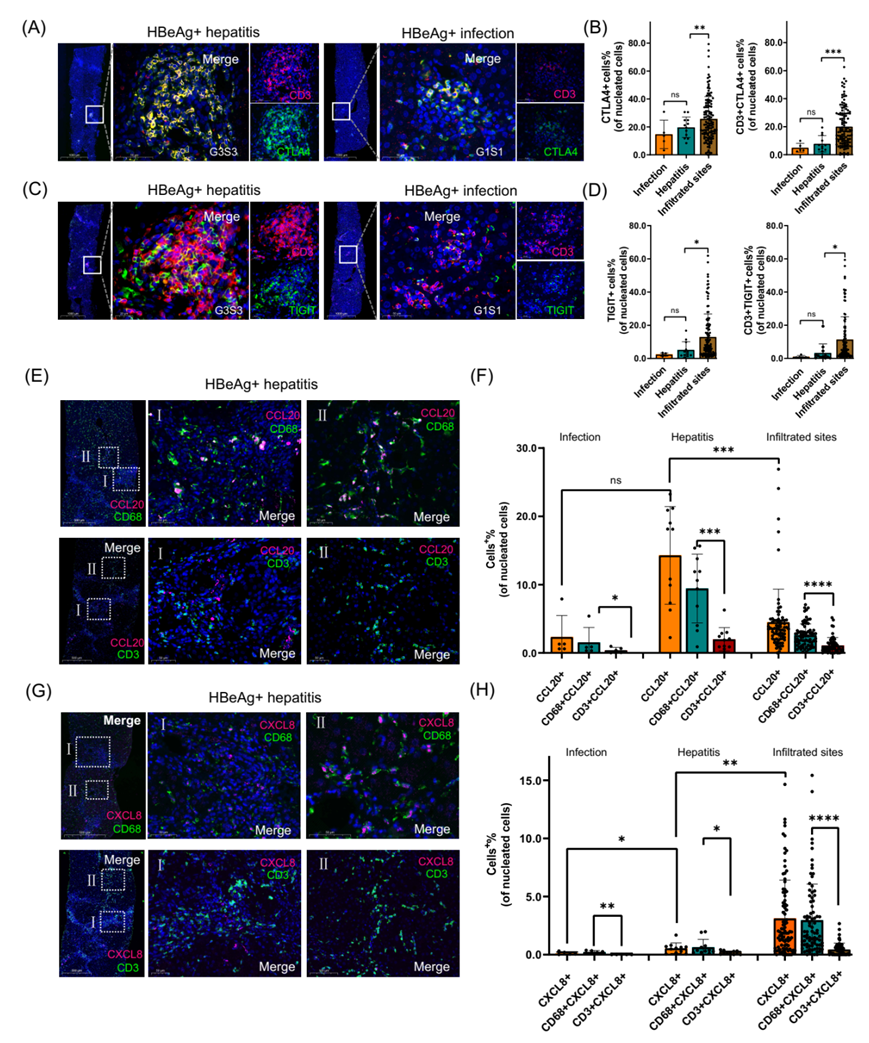
图6. T细胞耗竭标志物和巨噬细胞活化趋化因子的病理验证
研究团队进一步探索HBV慢性感染中另外一个重要的问题,即干扰素刺激基因(ISGs)是否被激活,为了探究ISGs在慢性HBV感染中的作用,我们在CHB肝脏炎症期和感染期(无肝内炎症)的患者肝脏组织样本中比较了341个ISGs的表达情况。我们使用PSEA的方法分析了所有CHB患者中不同肝细胞类型对这些ISGs的表达贡献。团队的研究揭示由肝细胞和B细胞表达的ISGs,如IFI44、ISG15、MX1和OAS3等不引起炎症反应,可发挥抗炎的作用。相反,ISGs如ISG20、IFI16、APOBEC3G等在T细胞和巨噬细胞中表达,参与肝脏炎症,损伤肝细胞,与血清ALT水平呈正相关(图6)。
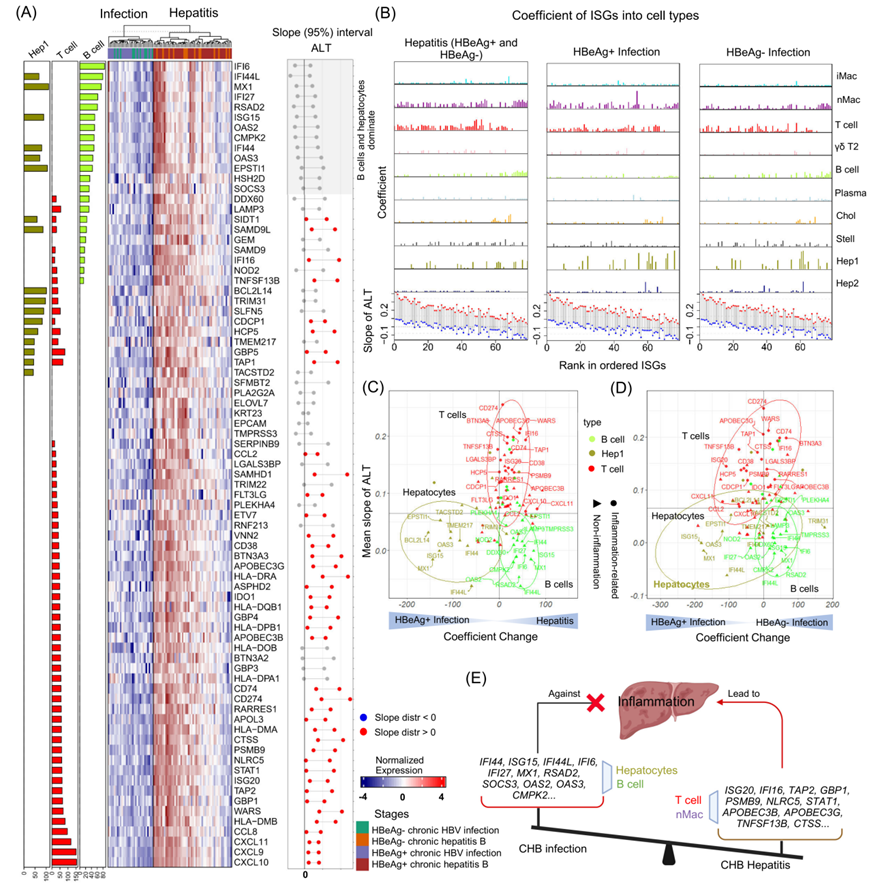
图7. 在CHB肝炎中细胞类型特异性干扰素刺激基因的不同作用
研究团队进一步对17例CHB患者的肝活检标本进行了IFI44与IFI16、ISG20与ISG15的双重免疫组化染色。对CHB肝脏中不同细胞类型特异性干扰素刺激基因进行了病理验证,并发现IFI44在c抗原阳性区域高表达及共定位,提示HBV在不同临床状态下刺激特异的干扰素刺激基因表达。
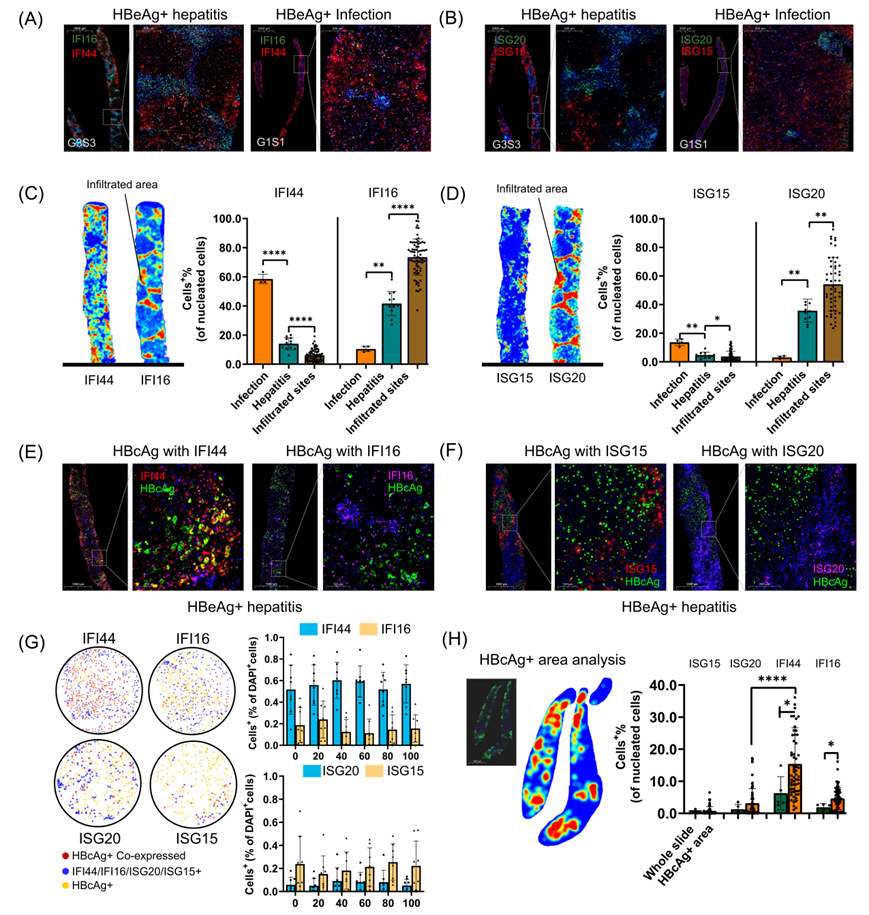
图8. 慢性乙型肝炎(CHB)肝脏中不同细胞类型特异性干扰素刺激基因的病理验证
理解宿主免疫反应、肝损伤与病毒控制之间的关系对慢性乙型肝炎(CHB)的研究至关重要。宿主免疫反应对于控制病毒复制至关重要,但在CHB患者中,肝内免疫活化未能有效控制HBV,导致肝损伤。因此,直接干预肝脏炎症的方法对于实现CHB的功能性治愈至关重要。研究团队整合了肝脏组织转录组数据、单细胞测序数据和临床数据,从多组学的视角分析了引发CHB肝脏炎症的因素。分析结果与之前的研究保持一致,即增加免疫细胞的肝内浸润导致肝损伤,且无法有效抑制HBV复制,而持续的HBV感染会进一步导致免疫细胞功能耗竭。在CHB肝炎阶段,肝细胞内的先天免疫被抑制,阻碍了ISGs发挥抗病毒效果,免疫细胞被招募并在肝脏中活化,是表达ISGs表达上调的主要来源,可进一步加剧了炎症形成。因此,肝内细胞群体异质性很强,随时间动态变化,并在肝组织中显示不均匀的空间分布。这也解释了不同ISGs的表达及其与ALT值的不同相关性。T细胞中激活的ISGs参与或进一步诱导肝内炎症形成。B细胞和肝细胞中激活的ISGs可能对肝脏的炎症损伤有保护作用。
研究结论与临床意义:
构建慢乙肝患者肝组织bulk组学数据,肝组织单细胞数据及患者临床数据的多组学分析方法,绘制慢乙肝肝内炎症发生的图谱,结果鉴定出慢乙肝炎症形成的重要机制:巨噬细分泌CCL20等趋化因子招募免疫耗竭的T淋巴细胞进入肝组织;同时肝细胞内天然免疫被抑制,ISGs无法启动抗病毒效应,而浸润入肝组织的免疫细胞天然免疫通路活化进一步加重炎症的形成。以上研究为慢乙肝功能性治愈提供了以下三种干预途径:
1.早期阻断肝内趋化因子CCL20,CXCL8,CXCL9,CXCL10的分泌;
2.改变肝内T细胞状态,抑制CTLA4通路或者活化B细胞;
3.干扰素治疗必须靶向肝细胞诱导肝细胞内ISGs上调,从而发挥抗病毒与抗炎症的效果。否则干扰素会诱导免疫细胞,如T细胞和巨噬细胞ISGs活化,反而增强炎症效应。选择合适的干扰素亚型组合诱导ISGs,如IFI44,ISG15,IFI44L,IFI6,MX1,RSAD2等或者直接构建这几种ISGs的mRNA肝内递送发挥抗病毒的同时,不会增加肝内炎症的负担。
附件:






 粤公网安备 44030702003859号
粤公网安备 44030702003859号
